Virologie
Le virus rabique appartient à la famille des Rhabdoviridae, et au genre Lyssavirus. Parmi les Lyssavirus, on distingue sept génotypes, le génotype 1, de distribution mondiale, comprenant les virus de rage classique, et les autres génotypes correspondant aux virus africains (génotypes 2, 3 et 4), européens (génotype 5 = virus de chauves-souris européennes de type 1 « EBL-1 » ; génotype 6 = EBL-2) ou australiens (génotype 7) apparentés au virus de la rage.
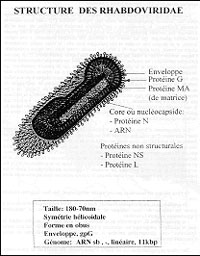
Le virus rabique est un virus à ARN négatif, non segmenté enveloppé, en forme d’obus .
C’est un virus fragile, qui ne peut se conserver qu’à l’abri de la lumière, de la sécheresse, de la chaleur et du contact avec des milieux trop acides ou alcalins.
Il possède un neurotropisme marqué ; on le retrouve plus particulièrement dans certaines zones du système nerveux (corne d’Ammon).
Le virus rabique comporte de nombreux variants, qu’on peut regrouper essentiellement selon leur situation géographique et selon leur espèce vectrice , mais aussi selon le contexte historique : le colonialisme a par exemple introduit en Afrique, en Asie et en Amérique des variants proches du groupe européen.
Ce virus est doué d’une grande malléabilité génétique, qui lui permet de s’adapter, par passages successifs, à une espèce donnée, et de devenir très virulent et très pathogène pour elle : le virus vulpin, étroitement adapté au renard, peut ainsi tuer 70 à 80% des renards vivant dans une région contaminée. Chaque souche virale a donc un tropisme pour une espèce particulière, et un pouvoir pathogène spécifique : les souches vulpines européennes sont par exemple relativement moins virulentes pour le chien et le chat, ce qui ne les empêche pas de pouvoir contaminer ces derniers. Cette malléabilité du virus le rend dangereux, puisque les espèces réservoirs sont très nombreuses, et les souches variées : il faut éviter qu’il puisse s’adapter à de nouvelles espèces, ce qui serait à l’origine de nouveaux cycles épidémiologiques, et nécessiterait de nouvelles méthodes de lutte.
Ainsi, depuis une vingtaine d’années en France, on a pu constater plusieurs cas de rage des chiroptères (génotype 5 ou 6), qui appellent à la vigilance tant que l’on n’a pas déterminé s’il s’agit d’une pathologie émergente ou non, à présent que la rage vulpine est éradiquée. Le problème est que les souches vaccinales, toutes issues du génotype 1, ne protègent pas ou peu contre les autres génotypes, ce qui rend la lutte contre les variants émergents plus délicate.
Les changements d’hôtes ont été très nombreux dans l’histoire des Lyssavirus : on peut citer l’adaptation d’un virus des chiroptères (l’un des rares de génotype 1) au raton-laveur en Amérique du Nord, du virus canin au renard lors de la progression du virus du Nord-est vers le Sud-ouest de l’Europe… Cette adaptation est relativement facile, car elle nécessite très peu de changements au niveau des acides aminés des protéines N et G. Les principaux facteurs d’adaptation à une nouvelle espèce sont la densité des nouveaux hôtes éventuels, et la proximité étroite de ces nouveaux hôtes avec l’espèce à l’origine de la contamination. En ce qui concerne le chien et le renard par exemple, l’adaptation est relativement aisée si les populations des deux espèces sont assez denses, le contact entre ces deux espèces étant alors très probable.
Le virus rabique est caractérisé par une unicité antigénique. Ses deux antigènes majeurs sont :
– la protéine de la nucléocapside (interne), dont la spécificité antigénique est commune à toutes les souches de virus rabiques et à d’autres Rhabdovirus, et qui caractérise l’appartenance au genre Lyssavirus.
– la glycoprotéine G, responsable de la virulence, qui a un rôle immunogène majeur, et dont la spécificité antigénique est commune à tous les virus rabiques, mais pas aux autres Lyssavirus ; cette glycoprotéine entraîne la synthèse d’anticorps neutralisants, et induit l’immunité humorale.
Des arbres phylogénétiques ont été établis d’après l’étude des séquences de gènes codant pour ces deux protéines, et montrent là encore une forte ressemblance entre les virus issus des mêmes régions géographiques ou des mêmes hôtes. Les branches les plus anciennes sont constituées par les virus du Nord et de l’Est de l’Europe, et les plus récentes par les virus de l’Ouest et du Sud de l’Europe, ce qui concorde avec l’évolution épidémiologique observée, à savoir une dispersion du virus rabique du Nord-est vers le Sud-ouest de l’Europe. Certaines branches phylogénétiques sont fortement regroupées géographiquement, comme par exemple les virus du Centre est de l’Europe ; la progression du virus peut en effet être stoppée par des barrières physiques, telles que la Vistule en Pologne, qui restreint le mouvement des hôtes infectés, et donc les possibilités de contamination. Badrane et coll. classent les Lyssavirus en deux grands groupes phylogénétiques, caractérisés chacun par une pathogénicité et une immunogénicité distincte : le premier groupe, formé par les génotypes 1, 4, 5, 6 et 7, est présent dans le monde entier, et est pathogène par voie intra-musculaire pour la souris, alors que le deuxième groupe, constitué des génotypes 2 et 3, ne se retrouve qu’en Afrique, et est pathogène uniquement par voie intracérébrale pour la souris, et non par voie intra-musculaire. Ce dernier paraît donc moins menaçant pour la santé publique.
Pathogénie
Le virus rabique est excrété surtout par la salive : il est transmis au cours d’une morsure, ou au contact de la salive avec une lésion traumatique. Il peut se multiplier localement dans le muscle au niveau du point d’inoculation, puis affecte les cellules les plus sensibles à son action, les neurones. La diffusion du virus rabique, contrairement à la plupart des autres virus, ne se fait pas par voie sanguine, mais par voie nerveuse.
Le virus commence par emprunter les voies nerveuses pour gagner le cerveau, où il se multiplie activement, puis regagne la périphérie et les terminaisons nerveuses par le système nerveux périphérique, et atteint certains organes, tels que le cœur (lésions de myocardite), l’œil, ou la peau. Le plus important est l’atteinte des glandes salivaires, où la multiplication virale est intense, ce qui permettra l’inoculation du virus par l’animal infecté au cours d’une morsure.
La majorité des neurones atteints ne semblent pas lysés par la multiplication virale ; l’altération des fonctions nerveuses pourrait être expliquée par des altérations du métabolisme des neurotransmetteurs impliqués dans la régulation de ces fonctions.
